抗がん剤の承認基準
科学的に延命効果証明は必須か?
イレッサ“薬害”訴訟大阪地裁判決では次のとおり認定している。
前記第5章第2の2(3)の認定・判断のとおり,平成14年7月当時,承認前には,比較臨床試験が実施されることは不可欠ではなく,腫瘍縮小効果(抗腫瘍効果)を代替評価項目として有効性を評価することには合理性があったというべきである。
仮に標準的治療法を対照群とした第III相試験において優越性ないし同等性が統計学的に証明されなかったとしても,II相承認の制度のもとでは承認時の有効性は既に肯定されているのであるから,そのことから直ちに当該医薬品の有効性が遡って否定されるものではない。
しかし,第III相試験の目的がさらなる標準的治療法の確立ということにある以上,第III相試験の結果,標準的治療法と比較して延命効果が確認されれば,有効性が再度確認されたこととなるだけでなく,標準的治療法に組み入れられることになるが, 第III相試験の試験デザインや規模などによっては,統計学的に適切な結果が得られないこともあり得るのであるから,第III相試験の結果において標準的治療法に対して優越性又は同等性を統計学的に示すことができなかったとしても,その事実のみをもって直ちに当該医薬品の有効性が否定されるものではない。 科学的な根拠に基づいて医薬品の有用性を判断すべきであるということと,第III相試験により全生存期間の延長について標準的治療法に対して優越性を示すということとは同義ではないにもかかわらず, 原告らの上記主張は,その前提において両者を混同するものであるか,その両者の関係の一部のみを取り出したものであるとの疑いがある。
また,第III相試験では,日本人患者の全生存期間の延長は確認されていないが,代替評価項目である無増悪生存期間から真の評価項目である延命効果があることを推測することができ, ファーストライン治療におけるEGFR遺伝子変異陽性の日本人を対象とした第III相試験(IPASS試験及びNEJ002試験)では無増悪生存期間の延長が確認されたのである。 したがって,日本人を対象にした第III相試験で延命効果が確認されていないという原告らの主張の前提は認められないものである。
大阪地裁は、奏効(腫瘍縮小)率や無増悪生存期間といった代替評価項目から延命効果の推測は可能としている。 では、「第III相試験の試験デザイン」によって「統計学的に適切な結果が得られないこともあり得る」とはどういうことか。
倫理的な問題
延命効果が証明されていない理由は以下による。 イレッサはいくつかのエビデンスレベル2の臨床第三相試験がおこなわれている。 イレッサか従来の抗がん剤のどちらかに割り当てられた二つの患者群で主要評価項目はPFS(無増悪生存期間)だ。 患者はコンピュータで勝手にどちらかに割り付けられるが(そのほうが意図的なものが入らず偏りが少なくてすむから)、一度腫瘍が増大したら、相当数の患者がもう片方の薬剤を投与されている(後治療という)事実が見過ごされている。 つまり非イレッサ群にもイレッサが投与されている率が高い。
これはクロスオーバーと言って、これがあるとどうしても生存期間に差が出にくくなるのだ。 では禁止すれば良いのではないかという意見もあるが、第三相試験はかなり有望と見られる新規薬剤が選択されているので、それを禁止するのは倫理的に問題だとされる事が多い。
そのため両群の生存期間の差が出てないと言うレッテルだけが一人歩きしているケースがよくみられる。
彼の最新刊「抗がん剤は効かない」では以下の文面があります。
昔と比べて長生きしているのは、おそらく錯覚です。 (中略) 抗がん剤で長生きするというのは,データ的に認められていない。 多数の臨床試験を積み重ねてきても、結局、証明されていないのです(p.61)
他にも大腸がんに対するベクティビックス、腎がん、肝がんに対するネクサバールでOS(全生存期間)が投与群で非投与群で差がないからなぜ認可されたのか、認可を取り消すべきだと主張しています。 PFS(腫瘍増大までの期間)良好だからと言っても検査時期で操作できるからだめだというわけです。
これに対しては以下の図を見てください。 ベクティビックスだけでなく他の抗がん剤のでも同じ論理で読者を欺いています。
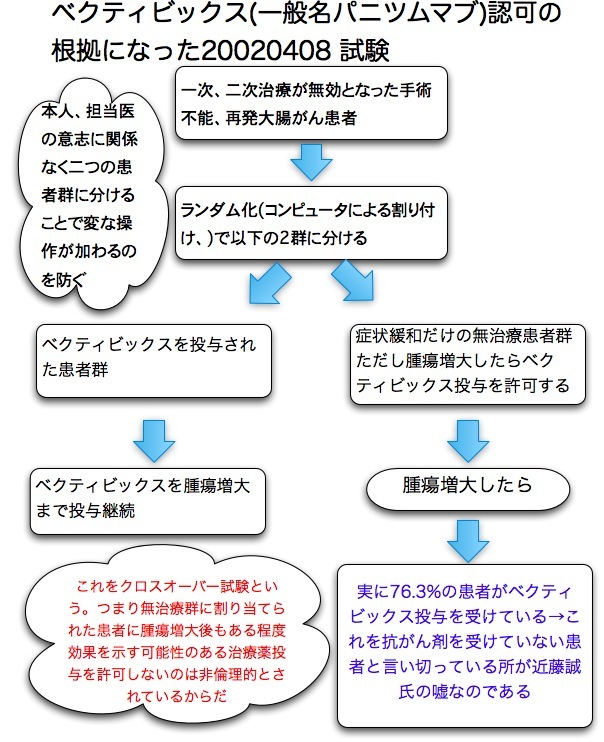
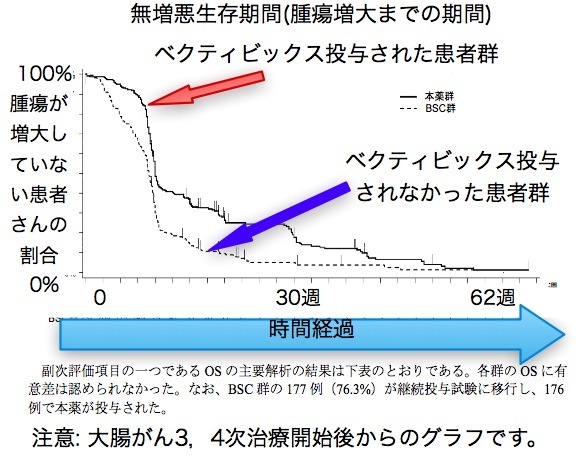
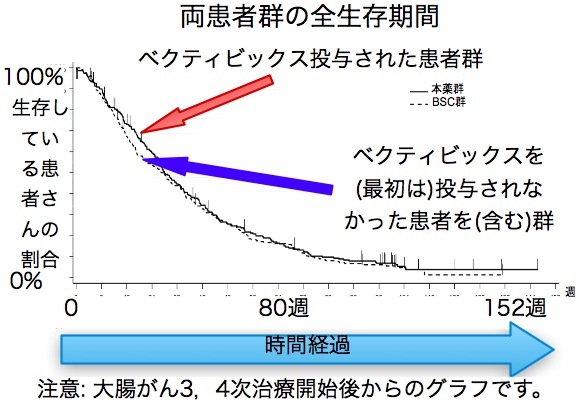
延命効果が証明されていないという主張はこのクロスオーバー試験と言う事実を隠蔽しているから可能なのだ。 彼の著書には一言も書いていないが、学会ではこのクロスオーバーこそが全生存期間で差が出ない理由の一つとして常識になっている。
画期的な新薬においては、倫理上の問題からクロスオーバー試験を実施せざるを得ず、その結果、全生存期間の差が得難くなる。
試験と現場の差
治験は、事前に作成した治験実施計画書に従って実施される。 原則として、治験実施計画書から外れることは認められない。 それは、治験実施計画書から外れた行為が、交絡要因となり、試験結果を大きく左右しかねないからである。 交絡が大きければ、統計的に信用できないデータとなり、治験結果の信頼性を大きく損なう。
一方、医療現場では、患者の状態に応じて試行錯誤を含めたきめ細かい対応を取ることが可能である。 一般的な抗がん剤は治療域(副作用なしに効果が出る投与量の範囲)が極めて狭く、場合によって、副作用が出る量の方が効果の出る量より少ない逆転現象も良く見られる。 また、量の個人差も大きいため、適切に使用しないと逆に命を縮める結果にもなりかねない。 副作用対策ひとつとっても、副作用死率を大きく左右する。 これは、次のように、よく知られた事実である。
「塩酸イリノテカン(CPT-11)」というわが国でつくられた非常にいい、最近注目されている薬がありますが、CPT-11は非常に強い副作用でたくさんの人が死んだと報道された薬です。 薬が売られる前の臨床試験中、4.4%、55名の人がその治療による死亡を経験しています。 市販後の死亡例数が――これが新聞に載った数字でありますが――0.77%です。
一方、米国におけるCPT-11は、臨床で2,360人に投与され、111人、4.7%が早期死亡、治療関連死が0.6%で、先ほどのわが国の数字と同じということになります。
医療現場では、そうした個人差等に応じたきめ細かい対応が行える。 しかし、試行錯誤による現場の対応を治験実施計画書に盛り込むことは極めて困難である。 その結果として、正しく使えば延命効果が期待できる抗がん剤であっても、臨床試験では延命効果が計れないということも起こりうる。
イレッサの場合
現実に起きたこと
イレッサの場合は、後に、EGFR遺伝子変異が見られる場合に、奏効確率が上がることが分かった。 そして、EGFR遺伝子変異が見られる患者だけを対象にした第III相試験が行なわれた。
そして今やEGFR遺伝子変異のある非小細胞肺癌患者ではイレッサは第一選択薬とする事が望ましいと言う第三相試験の結果が示された。
The new england journal of medicine 2010;362:2380-8.より引用
初回化学療法の進行非小細胞肺癌患者で、イレッサ感受性のEGFR変異を有する条件で2群に分け、イレッサ群と従来の標準治療であるカルボプラチン-パクリタキセル(化学療法群)に割り付けた。
200番目の患者を登録してから4カ月後に予定されていた中間解析は、200人のデータを対象に09年5月に行われた。 無増悪生存期間の中央値は、イレッサ群10.4カ月、化学療法群5.5カ月、化学療法と比較したイレッサの進行または死亡のハザード比は0.36(95%信頼区間0.25-0.51、P<0.001)となった。 この結果に基づいて、試験は早期中止された。
230人のデータを対象に行った最終分析では、無増悪生存期間の中央値は、イレッサ群10.8カ月、化学療法群5.4カ月で、ハザード比は0.30(0.22-0.41、P<0.001)。 1年無増悪生存率はイレッサ群42.1%、化学療法群3.2%。 2年無増悪生存率は8.4%と0%だった。 客観的奏効率も73.7%と30.7%で、イレッサ群で高かった(P<0.001)。
全生存期間の中央値は、イレッサ群30.5カ月、化学療法群23.6カ月で、差は有意にならなかった(P=0.31)。 2年生存率はそれぞれ61.4%と46.7%で、やはり差は有意ではなかった(P=0.31)。
NCI-CTCグレードが3以上の有害事象は、イレッサ群41.2%に対して化学療法群は71.7%と、化学療法群で有意に多かった(P<0.001)。
なお、イレッサ群の患者6人(5.3%)が間質性肺炎を発症、3人が重症化し、うち1人が死亡した。
簡単にまとめるとEGFR遺伝子変異のある患者さんではイレッサの方が圧倒的に成績がよくて(無増悪生存期間が2倍)試験が途中で中止になったということだ。
特筆すべきこととして副作用が概して軽いので、状態が悪くて従来抗がん剤治療に耐えられないような患者でも投与できる。 しかも効果が高いため、そこから患者が持ち直して長期生存するケースがでてきている事だろう。
そのため条件にあった患者では第一選択薬としてイレッサが望ましいと結論づけている。 生存期間に有意差はついていなかったが、従来の化学療法に割り当てられた患者群の95%が2次治療にイレッサを投与されており、前回言及したようにクロスオーバー試験であるため差が出せなかったのだろう。 イレッサが効く可能性の高い患者に投与しないのは倫理的に不可能だからやむを得ない。
全生存期間に有意差がないので、科学的には十分とは言えない。 しかし、差が出難い条件であるのに70%弱の確かさで7ヶ月の差は立派なものだろう。 100%完全な延命効果の証明とは言えないが、かなり確度の高い証拠とは言える。
もしも、全生存期間の有意差が承認基準だったら
もしも、全生存期間の有意差を証明することが必須だったら、イレッサはどうなっていただろうか。 まず、全生存期間の有意差を証明できなかった時点で、イレッサは承認されない。 承認されないから、使う人も少なく、データも蓄積されない。 そうすると、EGFR遺伝子変異と奏効との関係を調査した論文も出て来ない。 そのうち、製薬会社は、薬効の証明を諦め、特許権を放棄するだろう。 もしかすると、細々と使われた後に何年も経ってから、EGFR遺伝子変異と奏効との関係が突き止められるかもしれない。 しかし、その頃には、特許権が切れているので、新たな治験が行なわれることはない。
このように、全生存期間の有意差を証明することが必須であったならば、イレッサは永久に承認されずに闇に葬り去られていただろう。
イレッサは、
数カ月の余命が5年前後延びたスーパーレスポンダー(効果が顕著な患者)も多い
【夢の新薬 光と影】(上)2つの衝撃+(3/3ページ) - MSN産経ニュース
とされる。
しかし、全生存期間の有意差を証明することが必須であったならば、こうしたスーパーレスポンダー達の希望の灯が灯ることはなかった。
全生存期間の有意差を証明することが必須であったならば、イレッサは隠れたドラッグ・ラグ(レス)として、ひっそりと闇に葬り去られていたのである。
現実においてイレッサが使えるのは、奏効率で承認した後、EGFR遺伝子変異のある患者の延命効果が証明されるまで、承認を継続したからである。
もしも、途中で承認を取り消していたら、製薬会社が特許を放棄していた可能性がある。
承認を継続したからからこそ、特許庁に登録料金を支払うことを厭わずに製薬会社は特許を維持して、新たな治験を行なったのである。
医薬品の承認問題を語るにあたっては、この事実を絶対に忘れてはならない。
国際基準
2009年版WHOの固形がん効果判定基準でも奏効率と無増悪生存期間を指標とする(ただし、無増悪生存期間が用いられるのは近年の傾向)ことを前提としている。
背景:腫瘍量の変化を測定することは、がんの治療法を臨床的に評価するための重要な要素であり、がん臨床試験においては客観的な腫瘍縮小効果と原病の増悪の両方が重要なエンドポイントとして用いられてきた。 2000年にRECISTガイドライン(ResponseEvaluationCriteriainSolidTumors)が公表されて以来、多くの研究者、共同研究グループ、企業、政府機関等が、治療のアウトカムの評価のためにこの規準を採用してきた。 しかし、広く用いるうちに多くの疑問点と問題点が指摘されてきたことを受けて、この改訂版RECISTガイドライン(第1.1版)が作成されるに至った。 本特集号に同時掲載されている別稿に要約されている、今回の改訂の基となったエビデンスは、6,500例を超える大規模なデータベースでの評価やシミュレーション研究、いくつかの文献レビューにより得られたものである。
改訂版RECIST1.1のハイライト:今回の改訂における主な変更点は以下の通りである。
・評価対象とする病変数:効果判定のための腫瘍量の評価に必要とされる病変数を合計で最大10から最大5に減らした(臓器ごとに最大5から最大2へ)。 これは多くの試験の腫瘍縮小効果判定のデータベースの統合解析から得られた結果に基づいて決定された。
・病的リンパ節腫大の評価への組み入れ:短径15mm以上のリンパ節を測定可能とし、標的病変としての評価を可能とした。
腫瘍縮小効果判定に際しての腫瘍径の算出に、リンパ節の短径の測定値が含められた。 短径が10mm未満に縮小したリンパ節は正常リンパ節とみなす。
・効果の確定(confirmation):腫瘍縮小効果(奏効率)をprimary endpointとする試験では、効果の確定(confirmation)が必要であるが、ランダム化試験においては得られた結果を適切に解釈するために必要な比較対照群があるためにconfirmationは必須としない。
・進行(PD)の定義の明確化:腫瘍径の和がきわめて小さい場合に過剰にPDと判定することを避けるために、標的病変のPDとしてRESICT1.0での定義であった腫瘍径の総和の20%増加に加え、絶対値での5mmの増加が必要とした。
さらに、RECIST1.0での混乱の原因となっていた、測定不能病変や非標的病変の「明らかな増悪(unequivocalprogression)」に関する指針も提案された。
最後に、FDG-PETによる評価の解釈を含めて、新病変の検出に関する項目が盛り込まれた。
・画像診断の手引き:今回の改訂版RECIST1.1には、病変の至適な形態的評価(anatomical assessment)に関する最新の報告を付した、画像診断についての新しい付録が含まれている。
・今後の課題:RECISTワーキンググループがRECIST1.1の作成にあたって議論した主な問題は、形態に基づく腫瘍量の1次元評価から、3次元的形態評価やPET・MRIを用いた機能的評価への移行が適切か否かということであった。
しかし、ワーキンググループは、現時点では、腫瘍量の形態的な1次元評価を廃止するには、新しい方法の標準化やエビデンスが充分ではないと結論した。 ただし、唯一の例外として「増悪」の判定の補助として使用するFDG-PET画像を挙げた。 こうした新しい手法の使用については、本特集号の最後の論文でも詳述されているように、適切な妥当性研究が必要であると考えられる。
WHOの基準でも、全生存期間を指標とするよう求められてはいない。 イレッサについては米国FDAも奏効率で承認している。 だから、イレッサ“薬害”訴訟大阪地裁判決でも、代替評価項目で延命効果が推定できるとしているのである。 大阪地裁判決のとおり、「第III相試験の試験デザインや規模などによっては,統計学的に適切な結果が得られないこともあり得る」のだから、 全生存期間の有意差が出るまで承認しないのであれば、医薬品の承認が遅れるばかりではなく、延命効果のある医薬品の承認が認められない危険性がある。
余談
イレッサ問題とも、医薬品の承認問題とも直接関係がない話だが、奏効率による承認を批判する人には、インチキな“治療”法を支持する人が多い。 インチキな“治療”法を支持する人は、「延命効果の証明されていない抗がん剤を奏効率だけで承認するとはけしからん」と言う。 しかし、そんな人に限って、自分が支持する“治療”法については、延命効果どころか奏効率さえ証明されていないことを棚に上げている。 そんな人に限って、自分が支持する“治療”法の治療効果を科学的に証明しようとはしない。 そして、証拠にならない話ばかり並べて、自分が支持する“治療”法が医学的治療よりも優れていると力説する。 そういう類のインチキな話には気をつけた方がよい。
メニュー
経緯
判決内容
注意事項
医療問題
全般
イレッサ
偏向報道
- 社説イレッサ…と言う名のプロパガンダ(情報操作)
- イレッサ声明文案下書き問題(世論誘導)
- 予防原則の常識を根底から覆すイレッサ逆転無罪判決?
- イレッサ判決で原告が逆転敗訴・日本の「予防原則」が死んだ日?
訴訟
解説
- イレッサ指示・警告上の欠陥を常識で考える
- 予防原則に沿ったイレッサ高裁判決
- イレッサ大阪高裁判決速報
- イレッサ東京訴訟上告理由不備
- イレッサ訴訟トンデモ判決の原因分析
- イレッサ東京訴訟地裁判決と高裁判決の比較
- イレッサ東京高裁判決速報
- J&T治験塾への反論
- イレッサ訴訟地裁判決の問題点(MRIC)
- 製造物責任法とは?
原告の姿勢等
- イレッサ薬害訴訟の問題点
- 糾弾されるべきイレッサ訴訟原告
- イレッサ弁護団の詭弁
- イレッサ訴訟原告が医師を訴えない謎
- 99%の遺族がイレッサ訴訟原告に居ない事実
- 薬害イレッサ訴訟和解勧告の真相
- イレッサ原告また厚労相協議申入なる奇策
- 裁判所勧告を受けた国のコメントに関するQ&A
- “薬害”イレッサ訴訟・控訴抗議に対する抗議声明
- “薬害”イレッサ訴訟・原告控訴に対する抗議声明
- いわゆる『下書き』提供問題調査報告書声明に対する声明
- 7月27日「こんな癒着は許さない!薬害イレッサ脳内集会」を開催します!
- 薬害イレッサ訴訟東京高裁判決についての原告団・弁護団声明についての声明
- イレッサ原告の十八番=結果後付論法
- イレッサ大阪高裁判決院内報告集会における詭弁
- イレッサ薬害死亡者数の水増し(本当は70人強)
- イレッサ弁護団は馬鹿?
- 患者の治療の道を閉ざす原告の犬
関係団体等
- イレッサ薬害を沈静化した国の迅速な緊急安全性情報
- 患者団体はイレッサ“薬害”の見解を述べよ!
- “薬害”イレッサ訴訟で国と製薬会社の控訴は当然
- 国と製薬会社はイレッサ訴訟の求償権を行使して医師を訴えよ!