イレッサ薬害を沈静化した国の迅速な緊急安全性情報
原告による因縁
イレッサ弁護団の詭弁によれば、国の情報提供が不十分だったことになっている。 しかし、実際に検証してみると、国は、迅速かつ柔軟な対応をとって、薬害の拡大を未然に防いでいることが良く分かる。 原告は、国の超ファイン・プレイを讃えようとせず、エラーをしたのはけしからんと因縁を付けているだけである。
承認手続
悪魔の薬“薬害”イレッサ訴訟を参照。
最初の添付文書
「尋常ではない死に方。イレッサの影響があるはず。国はなぜ、承認時に副作用の危険性を訴えなかったのか」。国や輸入販売会社「アストラゼネカ」を訴えることを決意し、15人の弁護士に相談したが「抗がん剤の副作用で死んで裁判で勝てるわけがない」と相手にされなかった。
ようやく引き受けてくれたのが現在の弁護団の2人。その後、イレッサ承認前に間質性肺炎で死亡したり、致死的な症状になったりした事例が国内外で計7例あることをアストラゼネカと国が把握していたことを知り、怒りが込み上げた。
「娘の死無駄にできない」イレッサ訴訟で国が和解拒否:社会-中日新聞(http://www.chunichi.co.jp/article/national/news/CK2011012902000013.html)
新薬の販売承認には、実際に投与して効果や安全性を確かめる「治験」が必要。データの質を担保するため、比較的状態が良い患者が対象だ。
一方、病状が悪く治験対象とはならないが、代替薬などがない場合などに投与する「治験外使用」もある。副作用が重く出ることもあるため信頼性が低く、治験と同等には評価されない。
イレッサの場合、治験で3例の間質性肺炎発症が確認されたが、いずれも治療で回復。治験外使用では7例発症し、うち3例が死亡だった。
「薬事行政の根幹」と反発 イレッサ訴訟、強硬姿勢の国-中国新聞(http://www.chugoku-np.co.jp/News/Sp201101290077.html)
間質性肺炎はがんの進行でも発生する症状であるし、他の薬剤の副作用でも発生し得る症状である。 そして、「病状が悪く治験対象とはならないが、代替薬などがない場合」が対象となる「治験外使用」では、病状の悪さが間質性肺炎のリスクを押し上げていることが明らかである。 よって、「治験外使用」の事例では、何が間質性肺炎の原因となったか分からず、その薬剤の危険性を計る物差しとしての役目を果たさない。 治験での3例が全て回復し、「治験外使用」において「死亡したり、致死的な症状になったりした事例が国内外で計7例」では何も分からないに等しい。 これでわかることは「もしかするとイレッサの副作用かもしれない」という程度の漠然とした危険性でしかない。 それならば、添付文書等で「重大な副作用」の可能性を注意喚起することくらいが妥当な落し所だろう。 漠然とした危険性への書き方として「重大な副作用 間質性肺炎(頻度不明):間質性肺炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行うこと」と記述することの何処が問題なのか。 ちゃんと「重大な副作用」の可能性を記載してあるし、滅多に起きないというような過小評価も一切していない。 危険性を隠蔽したなら大いに問題あるだろうが、包み隠さずに正直に危険性をありのまま伝えたことの何が問題だと言うのか。 「『国内外で計7例』が『重大な副作用』程度の記載では不十分な危険性を示していた」と言えるのは結果が分かった今だからこそ言えることであって、当時のデータからは漠然とした危険性以上のことは知りようがない。 何故、その時点で知りようがない未来にのみ分かる結果論に基づいた警告を発しなかったことが問題だと言えるのか。
裁判所がそう判断されるならば、国や医療界も反省すべき点はあるのだと思いますが、添付文書に記載があってなお過失があると言われては、正直、現場は途方にくれてしまいます。
肺がん治療薬イレッサ(の訴訟にかかる和解勧告)に対する見解-日本医学会(http://jams.med.or.jp/news/015.html)
報道などによると、添付文書に間質性肺炎の副作用を記載して注意喚起しているのに、裁判所の所見では、記載が目立っていなかったなどの理由で国に責任があるとされているそうです。
がんの治療薬には常にリスクがあります。その上で医師も患者も薬の使用を決めるべきで、治療の現場では日常的に行われています。医師も読まなければいけない添付文書に書かれてある注意なのに、どうしてその承認がおかしいと言われているのか、記載の場所にばかりフォーカスがあたっていますが、患者と主治医のコミュニケーションの問題でもあるように思います。
このようなことで薬の承認が違法となれば、骨髄腫の治療薬として再承認されたサリドマイドのようなハイリスクな薬をもう2度と国は承認できなくなるのではないか、それにより、治療が受けられなくなる患者のことを考えていただいているのかと懸念しています。
私たちは、過去に薬害を起こした薬、サリドマイドを再承認してもらうために大変な苦労をしました。またこの先も、承認を待っている治療薬や治療法があります。これらの薬や治療法のリスクとベネフィットを医師と注意深く相談しながら私たちは命を繋いでいきます。
そのことを思えば、今回のイレッサ訴訟では一部のマスコミの意見に流されず、裁判所の方にもがん患者や医療に与える影響について考えていただきたいと節にお願いしたい気持ちです。
イレッサ訴訟の報道にふれて-日本骨髄腫患者の会(http://myeloma.gr.jp/2011/01/post-35.html)
原告の主張よりも、日本医学会や日本骨髄腫患者の会の主張の方がずっとまともである。
迅速な緊急安全性情報
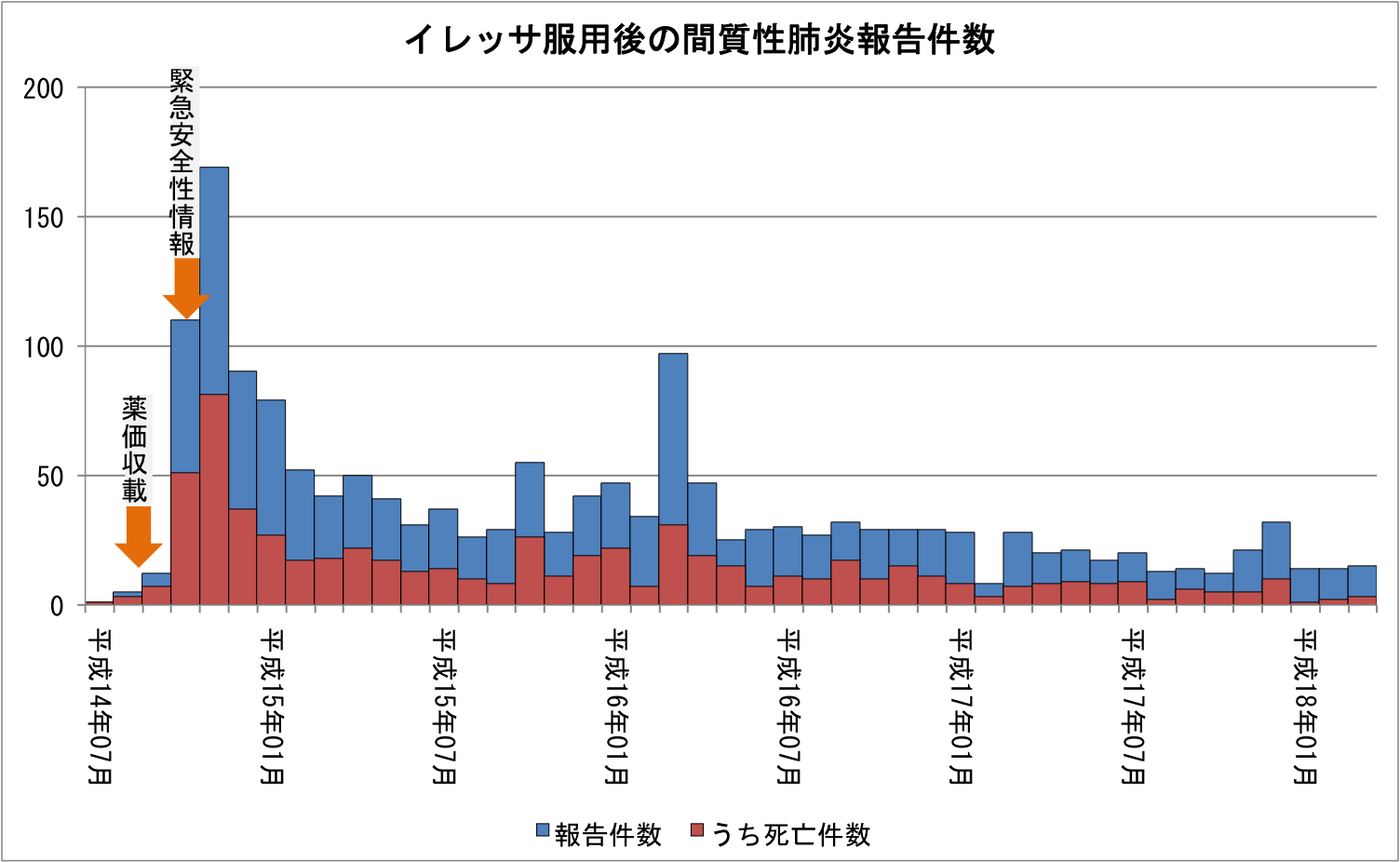
ゲフィチニブ服用後の急性肺障害・間質性肺炎等に係る副作用報告の報告件数等について-厚生労働省(http://www.mhlw.go.jp/houdou/2006/04/h0426-1.html)
このグラフを見ると、国の迅速な対応が良く分かる。 尚、横軸は報告月であって、発生月ではないので注意してみてもらいたい。 2002年の7~9月に比べ、10月の間質性肺炎の発生件数と死亡者数は急激に増えている。 これは次の3つの大きな原因が考えられる。
- 2002年8月31日に薬価収載(保険適用)
- 副作用としての間質性肺炎の発生は4週間以内が多い
- 死亡事例収集から報告までのタイム・ラグ
しかしながら、アストラゼネカ株式会社より、本年7月16日の販売開始以来22例(うち死亡11例)の間質性肺炎を含む肺障害が、また、医療機関から本年10月、同様の報告が4例(うち死亡2例)厚生労働省に報告された。これらの症例には投与開始後早期に症状が発現し、急速に進行する症例がみられている。
ゲフィチニブによる急性肺障害、間質性肺炎についての「緊急安全性情報」の発出について(http://www.mhlw.go.jp/houdou/2002/10/h1015-1.html)
10月の報告全体では110例(うち死亡51例)だが、厚生労働省はこのうち4例(うち死亡2例)の報告を受けただけで、製薬会社に対して添付文書の改訂と緊急安全性情報の作成及び医療機関等への配布を指示している。 10月の報告数は素人目に見ても明らかに被害が拡大していることが見て取れる。 しかし、厚生労働省は、このデータを受け取らないうちに被害対策を指示しているのである。 その後、11月に被害がピークに達した後、被害は減少している。 緊急安全性情報が出て直ぐに被害が減少しないのは、次のようなタイム・ラグがあったからだろう。
- 医療機関に緊急安全性情報が周知徹底されるまでのタイム・ラグ
- 投与してから副作用としての間質性肺炎が発生するまでのタイム・ラグ
- 死亡事例収集から報告までのタイム・ラグ
そして、時々、副作用被害が増えることもあるが、それは一時的かつ僅かな増加であり、短期間で元の値に戻っている。 副作用被害は増えたり減ったりしつつ、大きな流れで見れば、少しずつ減少傾向にあるのが見て取れる。 以上によれば、厚生労働省が迅速に副作用対策を打ち出し、それが功を奏して副作用被害が大きく減少している。 どう見ても、厚生労働省は、大勢の患者の命を守ったのであり、何処にも落ち度らしい落ち度は見受けられない。 これで、どうして、厚生労働省が批難されなければならないのか。
新情報の添付文書への適宜反映
原告は、何度も添付文書を書き替えたのがけしからんと言う。 原告は「書き替えるくらいなら、最初から書いておけ」と言う。 その時点で知りようがない結果論で批難することは、全くもって理解に苦しむ言動である。 厚生労働省は、被害の拡大を防ぐために、その時点で分かったことを添付文書に適宜反映させたのである。 いったい、多くの患者の命を救う為の行動の何処が問題なのか。
まとめ
以上の厚生労働省の対応をまとめると次のとおり。
- 真相は定かでないが因果関係が否定出来ないので添付文書の「重大な副作用」に間質性肺炎の注意書きを書かせた。(「重大」であって「軽微」ではない。)
- 被害が拡大する前に被害拡大兆候を事前に察知し迅速に緊急安全性情報を出した。結果的に間に合わなかった事例も少なくはないが、被害の拡大には一定の歯止めを掛けた。
- その後も、その都度、頻繁に添付文書を書き替えさせた。その結果、短期かつ小規模の副作用死の増加はあったが、全体的には副作用死は減少傾向となった。
いったい、何処に問題があるのか。 私には非の打ち所のない対応に見える。 予知能力でもない限り、これ以上の対応は不可能だろう。 唯一の落ち度は外部有識者として予知能力者を招聘しなかったことか?
- このページの参照元
悪魔の薬“薬害”イレッサ訴訟 糾弾されるべきイレッサ訴訟原告 薬害イレッサ訴訟和解勧告の真相 イレッサ弁護団の詭弁 イレッサ薬害訴訟の問題点 患者団体はイレッサ“薬害”の見解を述べよ! 7月27日「こんな癒着は許さない!薬害イレッサ脳内集会」を開催します! イレッサ薬害死亡者数の水増し(本当は70人強) イレッサ“薬害”訴訟を支援する会(仮)目次 患者の治療の道を閉ざす原告の犬 イレッサ事件の概要
このページへのご意見はイレッサ“薬害”訴訟支援BBSにどうぞ。
メニュー
経緯
判決内容
注意事項
医療問題
全般
イレッサ
偏向報道
- 社説イレッサ…と言う名のプロパガンダ(情報操作)
- イレッサ声明文案下書き問題(世論誘導)
- 予防原則の常識を根底から覆すイレッサ逆転無罪判決?
- イレッサ判決で原告が逆転敗訴・日本の「予防原則」が死んだ日?
訴訟
解説
- イレッサ指示・警告上の欠陥を常識で考える
- 予防原則に沿ったイレッサ高裁判決
- イレッサ大阪高裁判決速報
- イレッサ東京訴訟上告理由不備
- イレッサ訴訟トンデモ判決の原因分析
- イレッサ東京訴訟地裁判決と高裁判決の比較
- イレッサ東京高裁判決速報
- J&T治験塾への反論
- イレッサ訴訟地裁判決の問題点(MRIC)
- 製造物責任法とは?
原告の姿勢等
- イレッサ薬害訴訟の問題点
- 糾弾されるべきイレッサ訴訟原告
- イレッサ弁護団の詭弁
- イレッサ訴訟原告が医師を訴えない謎
- 99%の遺族がイレッサ訴訟原告に居ない事実
- 薬害イレッサ訴訟和解勧告の真相
- イレッサ原告また厚労相協議申入なる奇策
- 裁判所勧告を受けた国のコメントに関するQ&A
- “薬害”イレッサ訴訟・控訴抗議に対する抗議声明
- “薬害”イレッサ訴訟・原告控訴に対する抗議声明
- いわゆる『下書き』提供問題調査報告書声明に対する声明
- 7月27日「こんな癒着は許さない!薬害イレッサ脳内集会」を開催します!
- 薬害イレッサ訴訟東京高裁判決についての原告団・弁護団声明についての声明
- イレッサ原告の十八番=結果後付論法
- イレッサ大阪高裁判決院内報告集会における詭弁
- イレッサ薬害死亡者数の水増し(本当は70人強)
- イレッサ弁護団は馬鹿?
- 患者の治療の道を閉ざす原告の犬
関係団体等
- イレッサ薬害を沈静化した国の迅速な緊急安全性情報
- 患者団体はイレッサ“薬害”の見解を述べよ!
- “薬害”イレッサ訴訟で国と製薬会社の控訴は当然
- 国と製薬会社はイレッサ訴訟の求償権を行使して医師を訴えよ!